Ваш регион:
Москва
Санкт-Петербург
Амурская область
Архангельская область
Астраханская область
Белгородская область
Брянская область
Владимирская область
Волгоградская область
Вологодская область
Воронежская область
Ивановская область
Иркутская область
Калининградская область
Калужская область
Кемеровская область
Кировская область
Костромская область
Курганская область
Курская область
Ленинградская область
Липецкая область
Магаданская область
Московская область
Мурманская область
Нижегородская область
Новгородская область
Новосибирская область
Омская область
Оренбургская область
Орловская область
Пензенская область
Псковская область
Ростовская область
Рязанская область
Самарская область
Саратовская область
Сахалинская область
Свердловская область
Смоленская область
Тамбовская область
Тверская область
Томская область
Тульская область
Тюменская область
Ульяновская область
Челябинская область
Ярославская область
Адыгея
Башкортостан
Бурятия
Дагестан
Ингушетия
Кабардино-Балкария
Калмыкия
Карачаево-Черкесия
Карелия
Марий Эл
Мордовия
Республика Алтай
Республика Коми
Республика Крым
Республика Саха
Северная Осетия
Татарстан
Тыва
Удмуртия
Хакасия
Чечня
Чувашия
Алтайский край
Забайкальский край
Камчатский край
Краснодарский край
Красноярский край
Пермский край
Приморский край
Ставропольский край
Хабаровский край
Ненецкий автономный округ
Ханты-Мансийский автономный округ — Югра
Чукотский автономный округ
Ямало-Ненецкий автономный округ
Еврейская автономная область
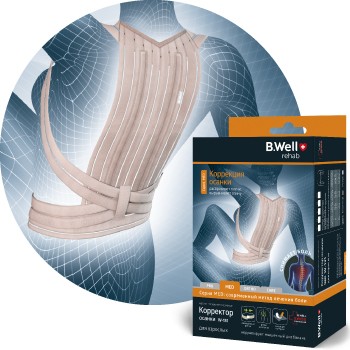
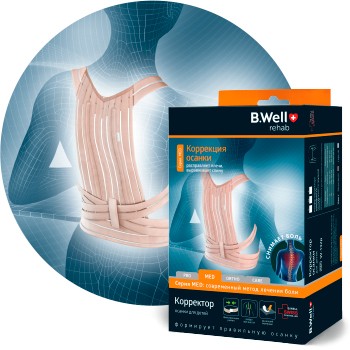
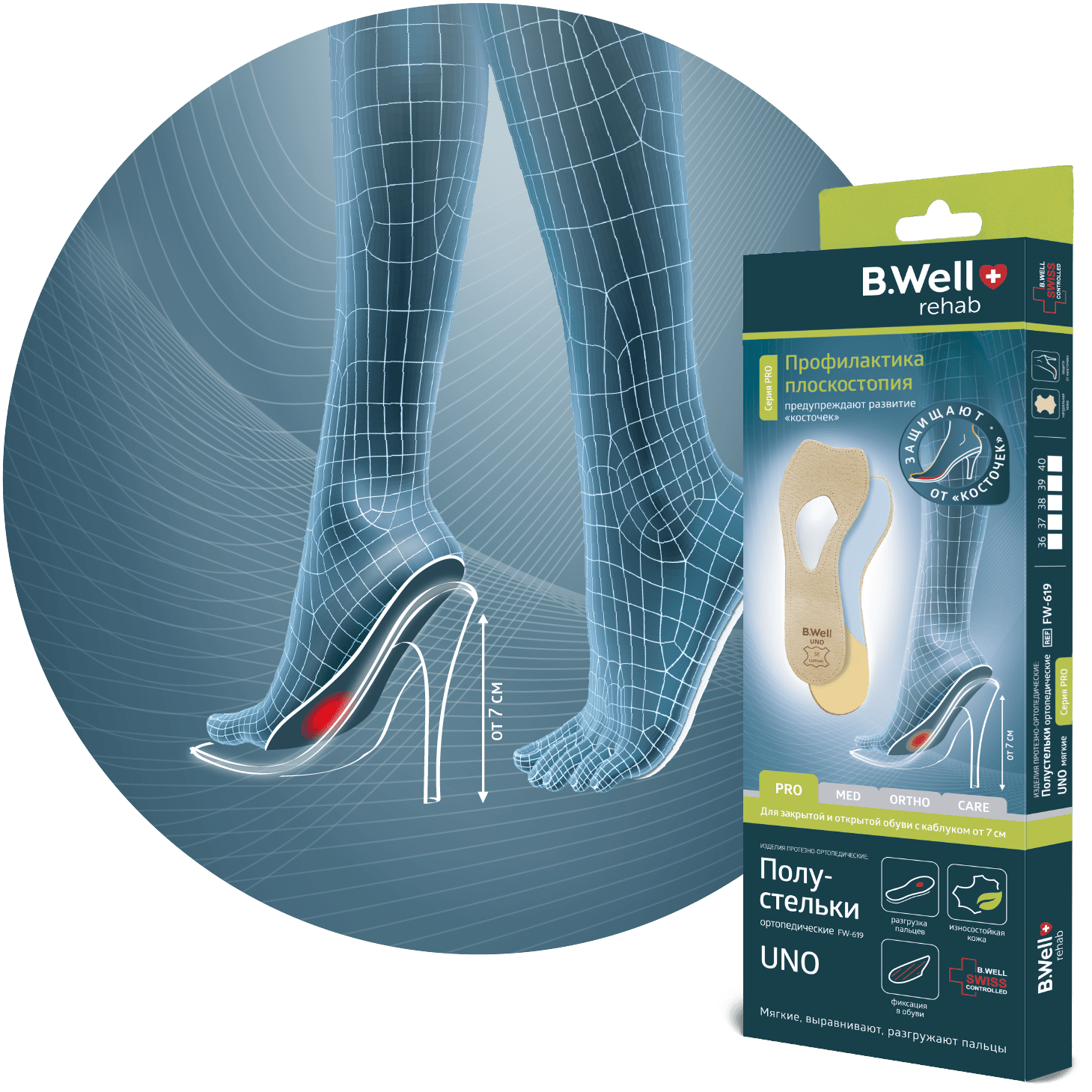
С ЗАБОТОЙ
О ЗДОРОВЬЕ
самых близких
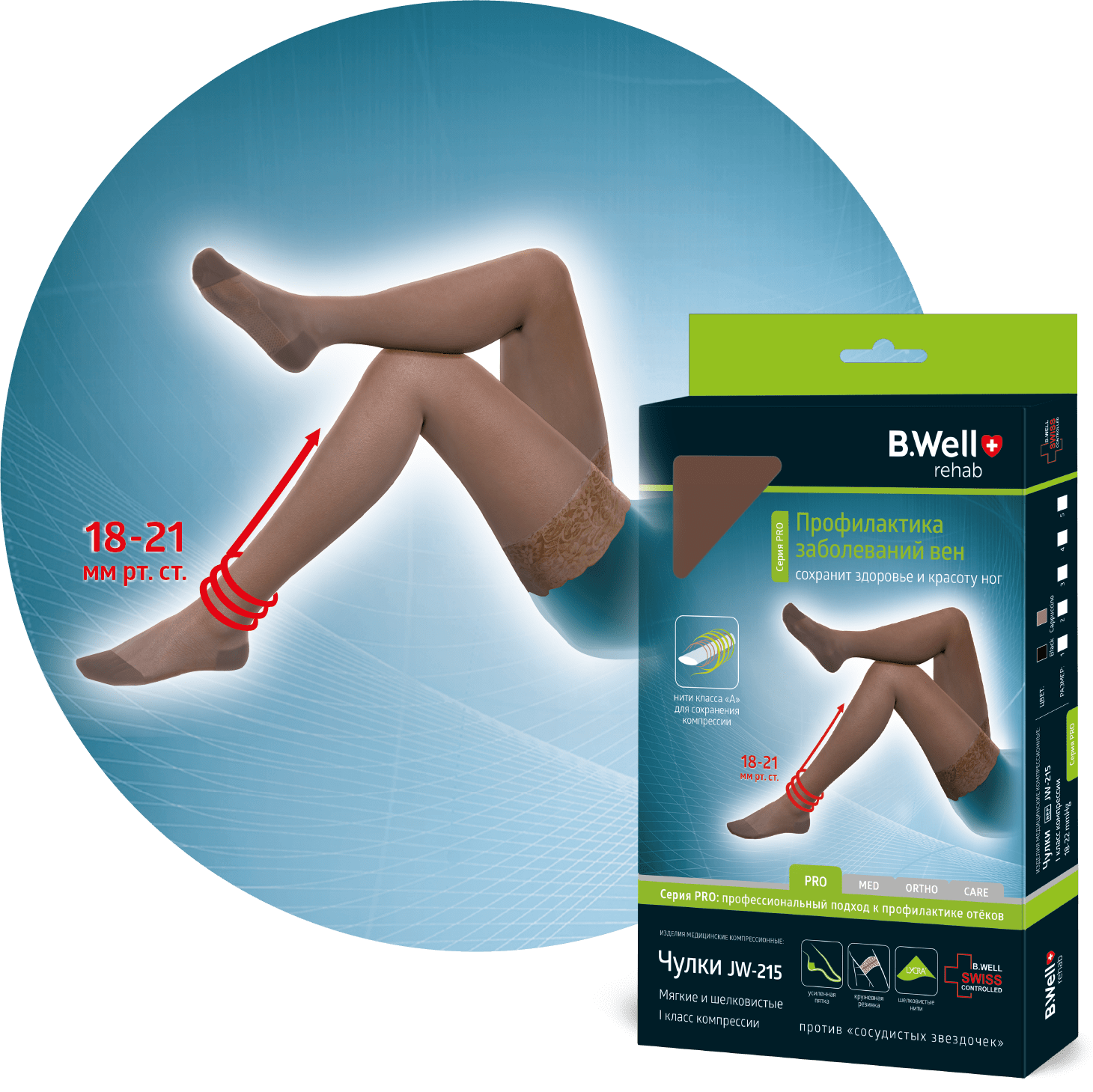
ОРТОПЕДИЧЕСКАЯ
ПРОДУКЦИЯ
для активной
семьи
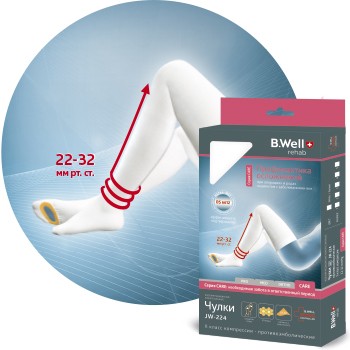
МЕДИЦИНСКАЯ ТЕХНИКА
ДЛЯ ВСЕЙ СЕМЬИ